La insulina es una hormona peptídica que regula el metabolismo de los carbohidratos. Los esteroles constituyen un grupo de productos naturales (metabolitos secundarios) con multitud de funciones biológicas; siendo el colesterol el congénere más relevante, que es un componente esencial de las membranas de las células de los mamíferos, precursor de la biosíntesis de numerosos esteroides (esteroidogénesis, ver figura), entre los que se pueden destacar diversas hormonas responsables de los rasgos sexuales (testosterona, estradiol y progesterona), hormonas reguladoras del balance de agua y electrolitos (aldosterona), hormonas reguladoras de procesos inflamatorios e inmunomoduladores (cortisol) y ácidos biliares (ácido cólico) que favorecen la digestión de las grasas. La penicilina, descubierta por Fleming y estudiada por Florey y Chan (los tres compartieron el Premio Nobel de Medicina en 1945), supuso una revolución en el tratamiento de las enfermedades causadas por bacterias, iniciando un área de investigación multidisciplinar en antibióticos. La vitamina B12 es un grupo de moléculas relacionadas estructuralmente que es esencial para los mamíferos, cuya deficiencia causa serias enfermedades en el desarrollo del sistema nervioso y de los glóbulos rojos; el papel químico de la vitamina B12 es participando como cofactor en una amplia variedad de reacciones enzimáticas (isomerizaciones, deshalogenaciones y transferencias de grupos metilo). Una peculiaridad estructural de la vitamina B12 es la presencia de un enlace entre un átomo metálico (el cobalto) y un átomo de carbono, siendo uno de los pocos compuestos organometálicos presentes en la naturaleza.
Aparte de su gran relevancia biológica, ¿qué tienen en común estas cuatro moléculas? La respuesta: Dorothy Crowfoot-Hodgkin.
Dorothy Crowfoot nació el 12 de mayo de 1910 en El Cairo, donde su padre, John W. Crowfoot, trabajaba para el Servicio Egipcio de Educación. En 1916, se produjo su traslado a Sudán, donde su padre había sido nombrado Director Adjunto de Educación. Durante este tiempo, Dorothy y su madre (Grace M. Hood) tuvieron tiempo para fomentar aficiones: coleccionismo y dibujos de flores (actualmente donados al Jardín Botánico de Kew), expediciones arqueológicas, amor por el arte, especialmente en tejidos textiles antiguos (de los que llegó a ser una experta internacional). Durante esta época, se fomentó su afición de colores y pautas, que fueron de utilidad para su posterior trabajo en cristalografía. Durante la Primera Guerra Mundial, Dorothy y sus hermanas menores (Joan y Betty, que nacieron en Sudán) se trasladaron a vivir con sus abuelos en Worthing (Inglaterra).
El interés de Dorothy por la ciencia, y especialmente por la química, empezó muy pronto, a los 10 años ya realizaba experimentos sencillos en su casa y a los 15 años leyó el libro The Nature of the Things escrito por William H. Bragg (el padre de la cristalografía química, Premio Nobel de Física en 1915), en la que éste destacaba que esta técnica experimental, aún incipiente, permitiría “ver” los átomos y las moléculas; lo que le pareció fascinante. Recomiendo el magnífico post de Ramón Andrade contando la influencia que este libro tuvo en la joven Dorothy.
Dorothy siguió una formación en química estudiando en la Universidad de Oxford (1928-1932), asistiendo a clases impartidas por Robert Robinson (Química orgánica, Premio Nobel de Química en 1947) y Cyril N. Hishelwood (Química física, Premio Nobel en 1956) y con excelentes conferenciantes como Ernest Rutherford (Premio Nobel de Química en 1908), Niels Bohr (Premio Nobel de Física en 1922) y Peter Debye (Premio Nobel de Química en 1936). Pero la conferencia que más le impactó fue la de un joven cristalografo de la Universidad de Cambridge, John D. Bernal (1901-1971; en la imagen), con el que decidió que haría su tesis doctoral. Durante su estancia en Oxford, Dorothy había iniciado su investigación en cristalografía en Oxford, publicando con Herbert M. Powell su primer artículo sobre la estructura de los haluros de dialquiltalio (Nature 1932, 130, 131-132).
Bernal está considerado como uno de los científicos británicos más brillantes del siglo XX. Un científico capaz de trabajar en múltiples temas. Durante su estancia en el grupo de Bernal, Dorothy Crowfoot aprendió que no hay fronteras entre las ciencias, que se puede realizar una investigación entre la química, la bioquímica, la física, y la cristalografía.
Tras finalizar su tesis doctoral en 1934 (sobre la estructura de esteroides; corrigiendo las estructuras propuestas inicialmente, fórmula de la izquierda en la imagen), Dorothy volvió a la Universidad de Oxford, donde permaneció durante el resto de su vida, siendo uno de los científicos más queridos (debido a su generosidad) y admirados de su época, creando una escuela de investigadores en cristalografía con intereses multidisciplinares. Desde 1937, tras su matrimonio con Thomas Hodgkin, su apellido cambió a Crowfoot-Hodgkin.
Elucidar la estructura de las cuatro moléculas indicadas al comienzo de este artículo ya sería suficiente para considerar a Dorothy Crowfoot como uno de los más importantes cristalógrafos (independientemente del género) de la historia, pero además hizo muchas más cosas, científicas (entre otras moléculas importantes se pueden citar los estudios con morfina y con gliotoxina) y sociales.
Por supuesto, su investigaciones más recordadas (y que le llevaron la mayor parte de su vida) fueron la determinación estructural de la insulina y de la vitamina B12.
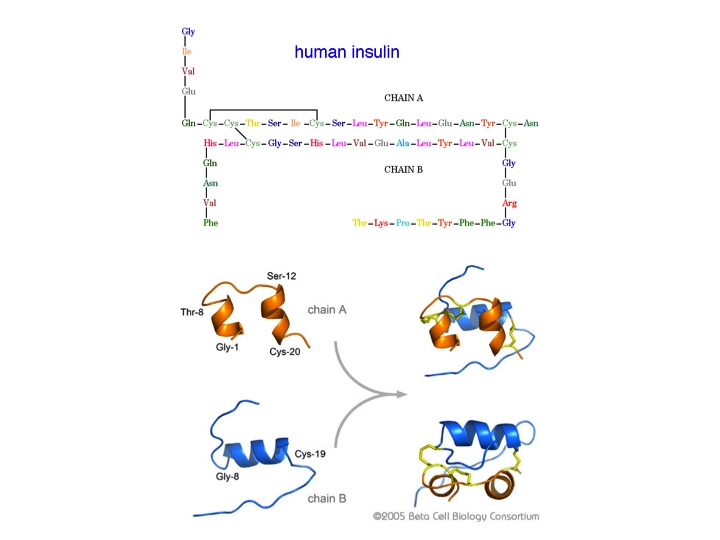
La insulina es una hormona que fue aislada en 1921 por Banting y Best de las células beta de los islotes de Langerhans del páncreas. Desde las primeras investigaciones se tuvo constancia de la relevancia de la insulina en el metabolismo de los carbohidratos y otras actividades fisiológicas; cuyo defecto podría conducir a enfermedades, como la diabetes.. Banting recibió el Premio Nobel de Medicina en 1923 (compartido con MacLeod), aunque con bastante polémica, que se puede leer aquí. Desde aquellos años, la insulina atrajo el interés de los químicos por conocer su estructura, siendo la cristalografía una herramienta poderosa en estos estudios. En aquella época no existín alas facilidades de equipamiento, métodos de cálculo y equipamineto informático de la actualidad (casi todo se tenía que hacer «a mano»), pero al mismo tiempo, este tipo de sstudios sirvieron para que la ciencia de la cristalografía química creciera. Em 1925 se pudo obtener insulina por cristalización (J. J. Abel) y en 1934 se identificó la presencia de cationes Zn (II) en la insulina aislada del páncreas.
La investigación de Crowfoot-Hodgkin sobre la insulina abarcó un periodo de 34 años, interrumpidos parcialmente por los estudios en vitamina B12 y penicilina, que empezó en 1934, cuando no se conocía la estructura primaria (ver imagen, determinada por Sanger en 1952; Premio Nobel de Química en 1958, por la determinación de la estructura de la insulina, y en 1980, por desarrollar métodos de secuenciación de ácidos nucleicos). La investigación de Crowfoot-Hodgkin en insulina permitió avanzar en el método del desplazamiento isomorfo, fundamental actualmente para determinar la estructura cristalina de proteínas. También permitió profundizar en los mecanismos de oligomerización de la insulina y sirvió de base para el diseño de derivados de insulina que podrían tener aplicaciones terapéuticas.
 La investigación en la estructura de la vitamina B12 es una obra maestra de la ciencia. En su momento fue la estructura química no-oligomérica más compleja resuelta cristalográficamente. La vitamina B12 es un complejo de corrina con cobalto. La corrina es un sistema macro-heterocíclico, parecido al de la profirina (componente de los citocromos, grupo heme de la hemoglobina, y clorofila). El cobalto de la vitamina B12 es hexacoordinado: cuatro de las valencias de coordinación son con la corrina, una quinta con un grupo dimetilbenzimidazol y la sexta posición es el sitio de recatividad. Como comentado anteriormente, la vitamina B12 es realmente un grupo de moléculas que se diferencian en el sexto ligando unido al cobalto. Este ligando puede ser un grupo ciano (cianocobalamina), un grupo 5′-desoxiadenosil (adenosilcobalamina; con un enlace covalente entre el átomo metálico y el carbono C-5′ del nucleósido, un compuesto organometálico, ver segunda imagen a continuación), un grupo metilo (metilcobalamina; también con enlace alquilo-metal), o un grupo hidroxilo (hidroxocobalamina).
La investigación en la estructura de la vitamina B12 es una obra maestra de la ciencia. En su momento fue la estructura química no-oligomérica más compleja resuelta cristalográficamente. La vitamina B12 es un complejo de corrina con cobalto. La corrina es un sistema macro-heterocíclico, parecido al de la profirina (componente de los citocromos, grupo heme de la hemoglobina, y clorofila). El cobalto de la vitamina B12 es hexacoordinado: cuatro de las valencias de coordinación son con la corrina, una quinta con un grupo dimetilbenzimidazol y la sexta posición es el sitio de recatividad. Como comentado anteriormente, la vitamina B12 es realmente un grupo de moléculas que se diferencian en el sexto ligando unido al cobalto. Este ligando puede ser un grupo ciano (cianocobalamina), un grupo 5′-desoxiadenosil (adenosilcobalamina; con un enlace covalente entre el átomo metálico y el carbono C-5′ del nucleósido, un compuesto organometálico, ver segunda imagen a continuación), un grupo metilo (metilcobalamina; también con enlace alquilo-metal), o un grupo hidroxilo (hidroxocobalamina).
Por todas estas investigaciones, y especialmente por la elucidación estructural de la vitamina B12, fue galardonada con el Premio Nobel de Química en 1964. Sin duda, un reconocimiento merecido.
La investigación de Dorothy Crowfoot-Hodgkin se extendió hasta casi su muerte (el 29 de julio de 1994), trabajando durante casi 60 años con una inmensa influencia en cristalografía, química y bioquímica. Con su investigación, la cristalografía se convirtió en una herramienta poderosa de determinación estructural de moléculas complejas, a partir de la cual se podían obtener datos importantes para entender las propiedades biológicas (lo que hoy se conoce como relación estructura-actividad). Dorothy Crowfoot empezó a trabajar en una época en la que no existían ordenadores, las intensidades se tenían que “determinar a ojo” y las estructuras se tenían que “calcular a mano”, contribuyó a desarrollar métodos que facilitasen el trabajo de “traducir” el dato experimental (intensidad de señales que se corresponde con densidades electrónicas) en posiciones atómicas. El desarrollo de algoritmos para este fin y la disponibilidad de ordenadores potentes facilitó el trabajo de los cristalógrafos de generaciones posteriores.
Además, Dorothy Crowfoot-Hodgking desplegó una intensa actividad como activista por la paz, intentando establecer lazos científicos y sociales con Extremo Oriente (especialmente China), y promoviendo el papel de la mujer en la ciencia. Formó parte activa de la fundación de la International Union of Crystallography (IUCr). También fue un miembro activo de la conferencia de Pugwash, movimiento fundado por Bertrand Russell, cuyo objetivo es el desarme nuclear y la paz mundial, siendo su presidenta entre el periodo 1975-1988. Una frase que decía (y que la define) es «tener enemigos es una pérdida de tiempo y energía«.
Sin duda alguna, recordar a esta gran mujer y científico es muy apropiado en cualquier momento y circunstancia, y sirve para reconocer el gran papel de la mujer en ciencia.
Bibliografía y referencias en INTERNET
- Videos de Dorothy Crowfoot-Hodgkin describiendo su trabajo en cristalografía, con la insulina y con la vitamina B12.
- The X-ray analysis of complicated molecules. D. Crowfoot-Hodgkin. Conferencia de aceptación del Premio Nobel de Química.
- Dorothy Mary Crowfoot Hodgkin, O.M. G. Dodson, Biogr. Mem. Fell. R. Soc. London 2002, 48, 179-219.
- Insulin, its chemistry and biochemistry, D. Crowfoot-Hodgkin, Proc. R. soc. London B 1974, 186, 191-215. Resumen de sus 34 años de investigación e insulina.
Nota-1: Este artículo es una versión ampliada del artículo originalmente publicado en la web de la SEBBM
Nota-2: Este post participa en el XXVII Carnaval de Química (el del cobalto, el metal de la vitamina B12), que aloja el blog Educación Química.
Bernardo Herradón García CSIC [email protected]