La esencia de la química no es sólo descubrir, sino crear nuevas expresiones de complejidad.
Esta frase la ha pronunciado Jean Marie Lehn (Premio Nobel de Química en 1987) durante su conferencia en el 63th Lindau Nobel Laureate Meeting (LNLM-13). Desde el primer minuto de la conferencia, Lehn convenció a la audiencia de la importancia de la química gracias a sus múltiples facetas y al valor que tiene para que otras ciencias, especialmente la física (las leyes del universo) y la biología (las reglas de la vida), puedan progresar. De hecho, Lehn representó a la química como un puente que une estas otras dos ciencias, lo que ya he discutido en post anteriores en algunos de mis blogs (algunos de los artículos o copias de las conferencias se pueden descargar en los siguientes enlaces: enlace 1, enlace 2, enlace 3, enlace 4, enlace 5).
La conferencia de Lehn fue después de dos investigadores que trabajan en la frontera entre la química y la biología: Aaron Ciechanover (Premio Nobel de Química en 2004) y Erwin Neher (Premio Nobel de Medicina en 1991), que hicieron presentaciones muy interesantes que comentaré en un próximo post. La conferencia de Ciechanover trató sobre el futuro del desarrollo de fármacos, llegando a la conclusión de que tendremos una medicina personalizada. Por otro lado, el título de la conferencia de Neher (Chemistry helps biology….) ya dejaba claro el matiz de su conferencia. En esta última conferencia se abordó las repercusiones biomédicas que tiene el estudio de los mecanismos de transmisión sináptica, lo que podría dar lugar a fármacos personalizados.
Lehn (en la imagen, durante su conferencia) empezó citando la medicina personalizada, los fármacos personalizados; para concluir que lo que realmente deberíamos tener en el futuro es una química personalizada. ¡Toda una declaración de intenciones!
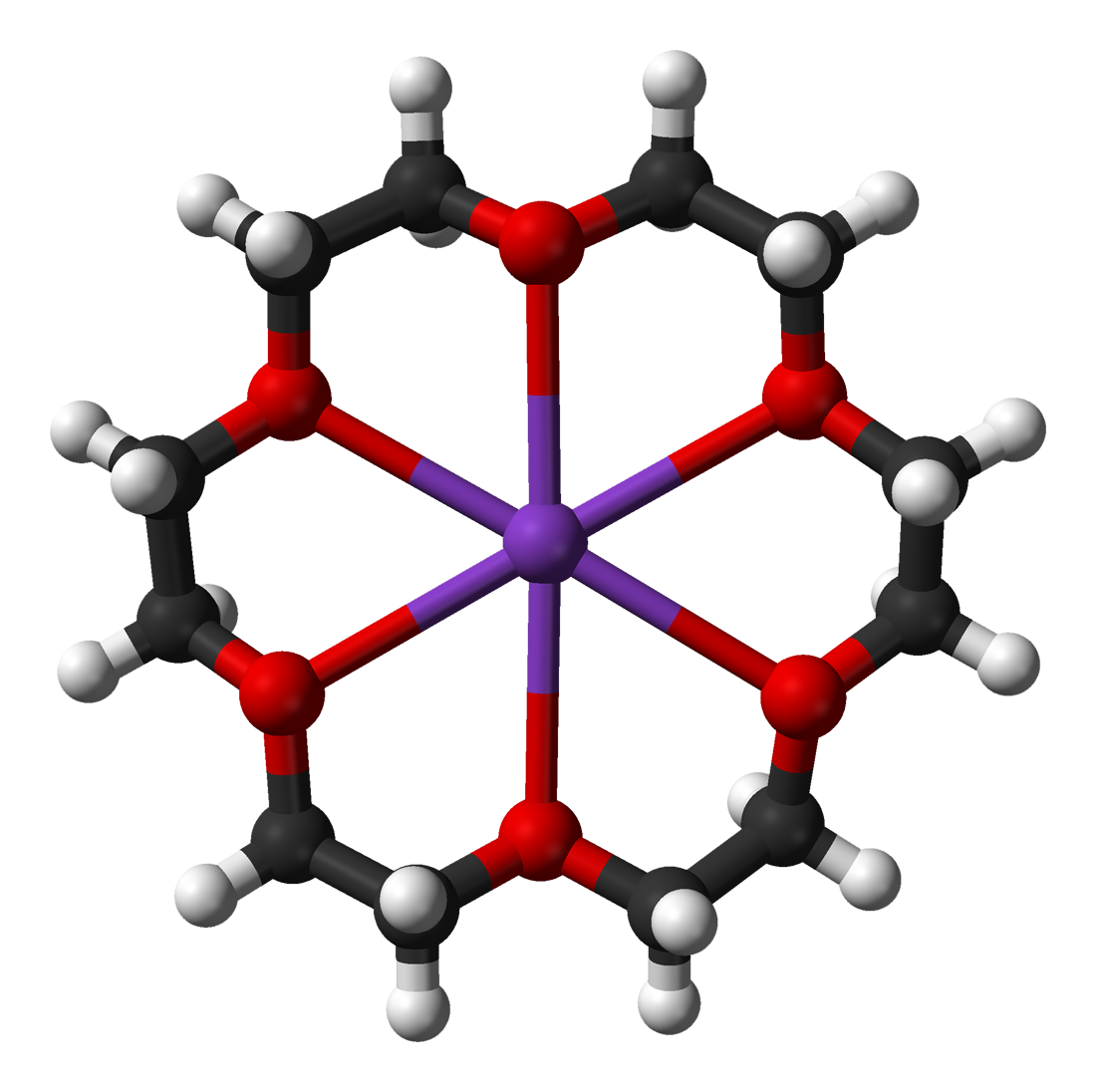
Durante su conferencia, Lehn remarcó como la química pasó del átomo a la molécula, dando lugar a, lo que durante mucho tiempo, se consideró la ciencia molecular. Posteriormente, y en investigaciones en las que él fue pionero junto a Donald Cram se pasó de una química molecular a una química supramolecular, basada en el reconocimiento molecular; es decir, como las moléculas (distintas o iguales) interaccionan entre sí; generando agrupaciones moleculares (las supramoléculas) que son, realmente, las responsables de las propiedades de la materia ordinaria que conocemos (dejemos a un lado la materia oscura). Lehn compartió el Premio Nobel con Cram y con Charles Pedersen, el primer científico que obtuvo un éter corona, que es un tipo de sustancias orgánicas capaces de complejar cationes. En la siguiente imagen, la estructura del 18-éter corona-6 complejada con el catión potasio (fuente: Wikipedia), uno de los éteres corona más sencillos, formada por 12 grupos metileno (CH2) y 6 átomos de oxígeno. Esta estructura es muy estable, pues los 6 átomos de oxígeno, actuando como base de Lewis, coordinan al catión potasio (ácido de Lewis).
La materia se forma por el ensamblaje de moléculas, a través de enlaces no-covalentes, pudiéndose asimilar a la fabricación de un dispositivo (por ejemplo, un secador de pelo) en el que vamos colocando las piezas adecuadas en el sitio correcto. Si las piezas interaccionan adecuadamente, se puede realizar una función; con las moléculas pasa lo mismo, si las moléculas interaccionan entre sí de manera adecuada, pueden llegar a realizar una función; este es el fundamento de las máquinas moleculares: dispositivos de tamaño molecular que son capaces de convertir una fuente de energía (generalmente calor o luz) en trabajo mecánico.
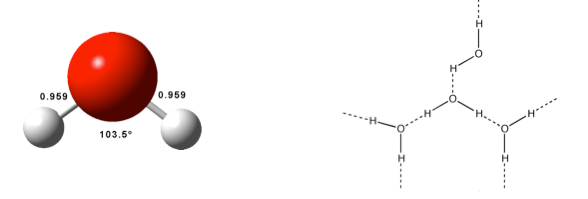
Volvamos a las interacciones no covalentes. Son la base sobre la que se sustenta la química supramolecular. A continuación algunos ejemplos de interacciones no-covalentes. Un tipo ubicuo de interacción no-covalente es el enlace de hidrógeno, que es el responsable de que el agua, la molécula más importante, tenga unas propiedades químico-físicas (alto punto de ebullición, bajo punto de fusión, alta capacidad calorífica, etc,), fundamentales para la existencia de vida en nuestro planeta.
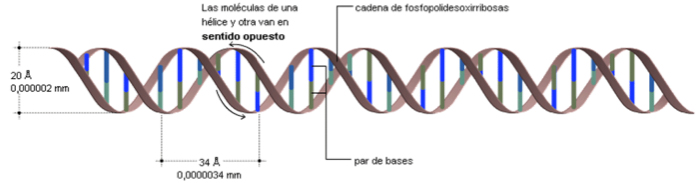
El enlace de hidrógeno también es reponsable de la existencia de la doble hélice en el DNA, de la estructura de las proteínas, y de las consecuencias de muchos procesos bioquímicos en los que participan estas biomacromoléculas.
Pero, además, los enlaces de hidrógeno son también los responsables de la existencia de las estructuras cristalinas en numerosos compuestos (en la imagen, la red de enlaces de hidrógeno, en rojo y azul, de un compuesto sintetizado en mi grupo).
Aunque los enlaces de hidrógeno son las interacciones no covalentes más frecuentes, no son las únicas; habiéndose identificado multitud de interacciones, cuya explicación queda fuera del alcance de este artículo; pero entre las que quiero destacar las participadas por compuestos aromáticos, un tema en el que llevo investigando bastante tiempo.
Por lo tanto, aunque los químicos hablamos siempre de moléculas, realmente nosotros nunca manipulamos moléculas, sino lo que hacemos es manipular un número muy grande (en la práctica podemos decir que infinito) de moléculas, esto es debido a que existe el número de Avogadro (un poco mayor de 6 x 1023 moléculas por mol) un número inmenso que nos da idea del diminuto tamaño de las moléculas. Por lo tanto, la materia existe porque existen las interacciones no-covalentes y los químicos pueden diseñar y fabricar materiales basándose en las posibles interacciones no-covalentes entre las moléculas del material.
Otra característica de las interacciones no-covalentes es que son débiles, en comparación con los enlaces covalente, lo que significa que se pueden romper (y volver a formar, o dar lugar a otro tipo de interacciones) fácilmente; lo que resulta en procesos dinámicos en los que varias especies supramoleculares pueden convertirse entre ellas.
Todas estas características (reconociminto molecular entre especies químicas, iguales o distintas; interacciones no covalentes; y procesos dinámicos) han sido usada por el grupo de Lehn para generar estructura supramoleculares que se pueden auto-organizar (de hecho, esta es la base de la auto-organización en sistemas biológicos) para llegar a realizar una función; es lo que Lehn define como química adaptativa; que es la razón por la que la materia es compleja. En este contexto, el diseño de las estructuras propuestas por Lehn se basan en dos conceptos: interacción para enlazar moléculas no-covalentemente e información para seleccionar función; llegando a la definición de la química como la ciencia de la materia informada.
En definitiva, una gran conferencia en la que demostró uno de los senderos por lo que transcurrirá la química en los próximos años.
Nota: Este post es una versión ampliada del artículo original publicado en el blog del LNLM-13.
Bernardo Herradón García
CSIC
[email protected]