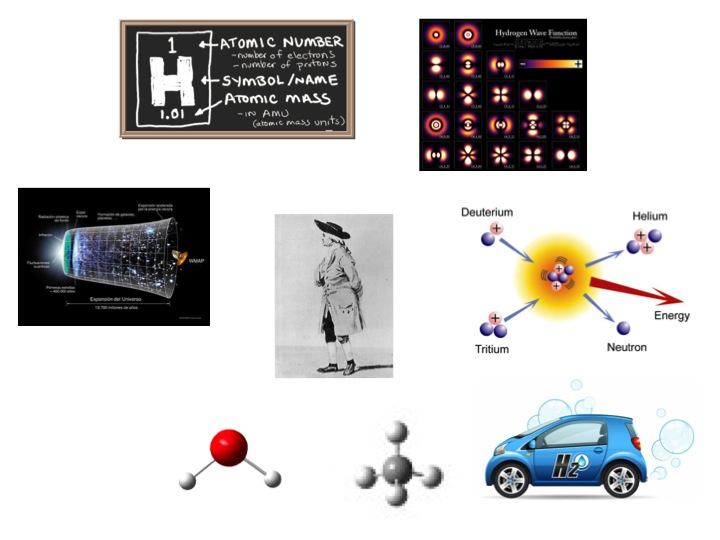
El hidrógeno (símbolo: H) es el átomo más sencillo que existe. Sólo un protón en su núcleo y un electrón alrededor de él. El hidrógeno ha sido muy importante en el desarrollo de los fundamentos de la Química: la explicación de las estructuras atómicas y molecular.
El protón es una partícula subatómica con carga positiva y el electrón es una partícula subatómica con carga negativa. La tercera partícula subatómica importante es el neutrón que también está en el núcleo atómico y que es neutra eléctricamente. El protón y el neutrón tiene aproximadamente la misma masa. El electrón es mucho más ligero (aproximadamente 1836 veces en reposo).
La principal característica de un elemento químico es el número de protones del núcleo, que se define como el número atómico. Puesto que la masa del protón y del neutrónes aproximadamente iguales, la suna del número de protones y neutrones es, redondeando a números enteros, la masa atómica (también frecuentemente denominado peso atómico). La masa de los electrones se desprecia a la hora de calcular la masa de los átomos.
Los elementos químicos pueden tener más de un tipo de átomos, que se conocen como isótopos. Los isótopos son los átomos de un elemento químico que, teniendo el mismo número de protones (que define el elemento en cuestión), poseen diferente número de neutrones; por lo tanto, masas distintas.
El hidrógeno es el componente más abundante del universo, constituyendo aproximadamente el 75% de la masa conocida y más del 90% de los átomos del universo. El hidrógeno (número atómico, 1), el helio (número atómico, 2) y el litio (número atómico, 3) fueron los tres elementos que se formaron en el big-bang . Todos los elementos químicos naturales (hasta el número 92 en la tabla Periódica) se formaron como consecuencia de la nucleosíntesis tras el big-bang, primero el hidrógeno, luego el helio y, así sucesivamente, los elementos más pesados según su número atómico.
Las estrellas están principalmente constituida por hidrógeno en forma de plasma (un estado de la materia distinta a las habituales que conocemos: gas, líquido o sólido). En un plasma hay separación de iones. En las estrellas, los núcleos de hidrógeno (cargados positivamente) están agrupados y los electrones (cargados negativamente) están separados de los núcleos. Este estado de la materia tiene una altísima conductividad eléctrica. El núcleo del Sol está formado por hidrófgeno, altamente comprimido y a muy alta temperatura (13 millones de grados). La densidad del núcleo del Sol es aproximadamente de 200 kg/l (compara con la densidad del hidrógeno en condiciones normales de presión y temperatura, que es de 0’00009 kg/l, 2’2 millones de veces menor. En estas condiciones, los nucleos de hidrógeno se fusionan. De esta fusión niclear se genera gran cantidad de energía (lo que se pretende hacer en las plantas de fusión nuclear, como el ITER). La radiación generada en el núcleo del Sol tarda un millón de años en alcanzar la superficie de la estrella. El Sol convierte 600 millones de toneladas de hidrógeno en helio por segundo, convirtiendo alrededor de 5 millones de toneladas de materia en energía (según la ecuación de Einstein, E = mc2.
El hidrógeno (elemento de número atómico = 1, ocupando el primer lugar en la Tabla Periódica) tiene tres isótopos; que difieren en el número de neutrones del núcleo, pudiendo ser cero, uno o dos. El que tiene un solo protón se denomina hidrógeno (o protio, un término poco usado) y es el isótopo más abundante. Se denota por 1H (el superíndice indica el peso del isótopo = número de protones + número de neutrones). El otro isótopo del hidrógeno es el deuterio, que tiene un protón y un neutrón en el núcleo, simbolizándose por 2H. La proporción de isótopos del hidrógeno en nuestro planeta es de entre 12500 y 1800 átomos de protio por cada átomo de deuterio (dependiendo del compuesto químico y de su origen). El deuterio fue aislado por Harold Urey en 1931, recibiendo el Premio Nobel en 1934.
Existe un tercer isótopo del hidrógeno (el tritio, 3H) que tiene dos neutrones en el núcleo. Es mucho menos abundante que el deuterio. Se forma por la interacción de rayos cósmicos con la atmósfera terrestre. También se genera intencionadamente en reactores nucleares, pues tiene aplicaciones en investigaciones químicas, físicas y biológicas.
Un átomo, para mantener su neutralidad eléctrica, tiene que tener el mismo número de electrones que de protones. Si uno de ellos está en exceso, se forman los iones, que pueden ser negativos o positivos, dependiendo de que haya más electrones que protones (iones negativos o aniones) o menos electrones que protones (iones positivos o cationes).
Excepto en el caso de los gases nobles más ligeros, que se encuentran en estado monoatómico; el estado normal de todas las sustancias químicas es formar moléculas: los átomos quieren combinarse entre sí, compartiendo electrones que forman los enlaces químicos. Aunque el hidrógeno se puede generar en estado atómico, esto se consigue en condiciones muy especiales. La forma en la que el elemento químico hidrógeno se encuentra en la naturaleza es en forma de una molécula con dos átomos de hidrógeno, generando la molécula de dihidrógeno (H2, dónde el subíndice indica cuantos átomos están combinados en esa estructura), frecuentemente denominada sólo “hidrógeno” o “hidrógeno molecular”. El dihidrógeno es un gas con un punto de ebullición de 20 K y con punto de fusión de 14 K a presión atmosférica.
El hidrógeno fue generado en el siglo XVII por Robert Boyle al tratar ciertos metales, como zinc o hierro, con ácidos fuertes; y fue aislado por Henry Cavendish en 1766. El dihidrógeno se produce industrialmente por reacción de metano con agua generando una mezcla de monóxido de carbono (CO) y H2, que se denomina gas de síntesis (que también se puede obtener a partir de carbón). También se puede generar por electrolisis de la molécula de agua.
La principal aplicación industrial del hidrógeno es la producción del amoniaco; el compuesto químico más importante en la fabricación de abonos y fertilizantes, que mejoran nuestras cosechas proporcionando alimentos.
El dihidrógeno es un gas muy inflamable. Esta propiedad es debida a que la reacción con oxígeno genera mucho calor. Esta reacción, aunque potencialmente peligrosa, se puede usar de manera controlada para producir energía. La energía generada por la combustión del hidrógeno es limpia y eficaz. Si se resuelven problemas científico-técnicos, como la producción eficiente de H2 y su almacenamiento y transporte seguros; podremos beneficiarnos de la energía química del H2, llegando a alcanzar la denominada economía basada en el hidrógeno.
Otras características importantes del elemento hidrógeno (a comentar en un próximo post) son su capacidad para formar enlaces no covalentes débiles (enlace de hidrógeno) o sus propiedades espectroscópicas que sirvieron de estímulo para el desarrollo de la teoría cuántica.
Lecturas recomendadas:
John Emsley, Nature’s Building Blocks, Oxford University Press, 2003.
Theodore Gray, The Elements. A Visual Exploration of Every Known Atom in the Universe, Black Dog & Leventhal Publishers, 2009.
Conceptos de química, para ampliar la información:
- Protón
- Neutrón
- Electrón
- Enlace químico
- Nucleosíntesis
- Fusión nuclear
- Tabla periódica
- Número atómico
- Peso atómico. Peso atómico estándar.
- Modelos atómicos: desarrollo histórico
- Experimentos que permitieron descubrir las partículas sub-atómicas
- Rayos catódicos
- Espectrometría de masas
- ¿Hay alguna partícula más pequeña que forme el neutrón? ¿Y el protón? ¿Y el electrón?
- Busca quién fue Henry Moseley y por qué fue importante en el desarrollo de la teoría atómica.
- Busca datos de la biografía de Henry Cavendish. ¿Qué te llama la atención de su biografía? ¿Qué destacas de positivo y negativo de su biografía? ¿Te gustaría ser como él?
- Buscar aplicaciones científicas y médicas de isótopos radiactivos.
- Gases nobles. ¿Qué son? ¿Cómo se descubrieron? ¿Dónde se encuentran en la Tabla Periódica? ¿Cual es su característica química principal? ¿Por qué?
- Reacción de producción de amoniaco.
- Reacción de electrolisis del agua.
- Reacción de oxidación del hidrógeno.
- Fertilizantes y abonos.
- Gas de síntesis.
- Economía basada en el hidrógeno.
Actualizado de mis artículos anteriores publicados en:
http://www.quimica2011.es/ciencia-central/el-hidrógeno-¿futura-fuente-de-energí
https://www.losavancesdelaquimica.com/blog/2011/08/31/divulgacion/ensenanza/el-hidrogeno/
Bernardo Herradón